Uso de las baterias de litio

En InElectronic sabemos que la forma habitual de comunicarnos (teléfono móvil) y la manera de desplazarnos (patinetes, vehículos eléctricos, híbridos, etc.) depende del adecuado funcionamiento de un elemento que proporciona la energía necesaria para el funcionamiento de todos los dispositivos indicados: la batería recargable. Dentro de esta categoría, las baterías de iones de litio (en lo que sigue ion-litio) es, sin lugar a dudas, un dispositivo que recibe ingentes inversiones en I+D con objeto de aumentar su duración, reducir su peso y rebajar su precio. Los grandes fabricantes de teléfonos móviles y las compañías fabricantes de vehículos eléctricos, están invirtiendo fuertes sumas de dinero en el desarrollo de la siguiente generación de baterías de ion-litio de altas prestaciones.
Las expectativas del mercado de estas baterías son extraordinarias. La siguiente imagen muestra la evolución prevista de estos dispositivos en sus tres principales aplicaciones: sistemas de almacenamiento de energía (el más famoso de estos es el de las célebres baterías Powerwall/Powerback de Tesla, sin olvidar las numerosas opciones que comercializan otras empresas), vehículo eléctrico y telefonía móvil:
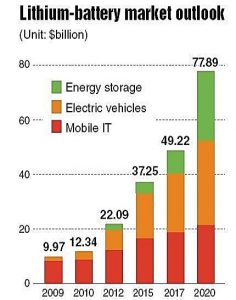
Evolución y perspectivas para el período 2010-2020 del mercado de las baterías de ion-litio, expresado en miles de millones de dólares USA. Fuente: Lithium-battery market outlook.
Una de las principales fuentes de crecimiento para este mercado son las baterías destinadas a los vehículos eléctricos. En esta aplicación, las celdas-pilas se agrupan entre sí con múltiples unidades para proporcionar la energía necesaria que permite el funcionamiento de un vehículo de gran autonomía, como se muestra en la siguiente imagen:
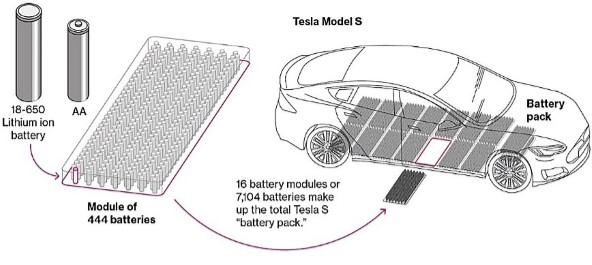

Esquema de la batería de un vehículo eléctrico, modelo Tesla S, construida a partir de la unión de más de 7000 pilas de ion-litio del modelo 18-650, muy similares en tamaño y forma a las clásicas AA. Están agrupadas en 16 módulos de 444 pilas. La batería en su conjunto pesa alrededor de 600 kg., aunque solo 7 kg. son de litio. Fuente de la figura: Jessica Shankleman, Tom Biesheuvel, Joe Ryan y Dave Merrill. Bloomberg Businessweek, 7-septiembre-2017
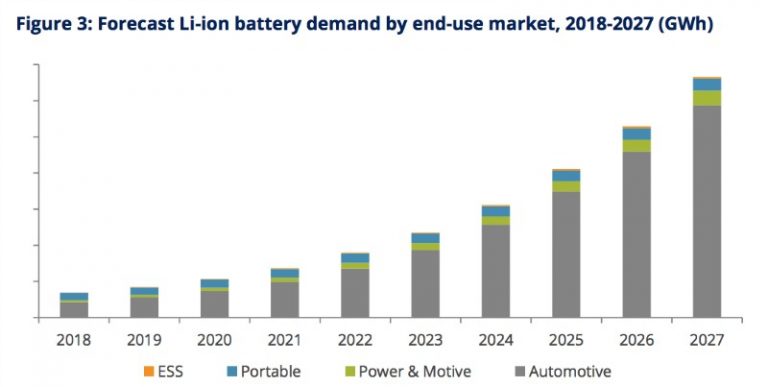
En la próxima década, está previsto un enorme incremento de la demanda de estas baterías, especialmente para su aplicación en vehículos eléctricos:
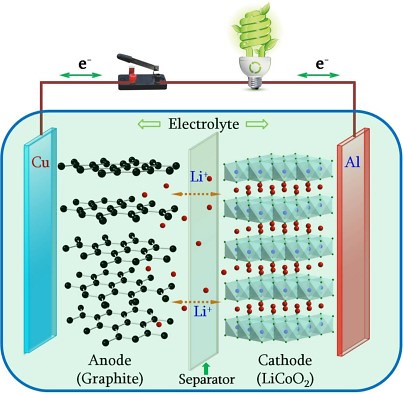
Proceso de carga-descarga de una batería de iones de litio
En las baterías de ion-litio, los iones se mueven en un sentido cuando la batería se carga, es decir, cuando absorbe la energía que le proporciona una fuente externa y se mueven en sentido contrario cuando la batería se descarga, que es el momento en el que la batería está suministrando energía a un determinado dispositivo: un teléfono móvil, un patinete, un vehículo eléctrico, etc. El proceso se muestra en la imagen:
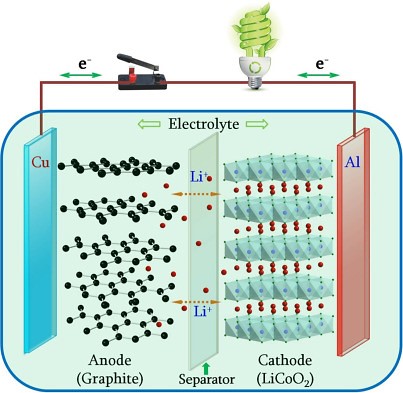
Esquema interno de una batería de ion-litio. Los iones de litio están representados por puntos rojos; en el ánodo, los átomos de carbono están representados por puntos negros, agrupados en capas hexagonales. Durante el proceso e carga de la batería, los iones de litio se desplazan desde el cátodo de LiCoO2 hacia el ánodo de gafito, mientras que los electrones hacen lo mismo, pero a través del circuito externo. En la descarga, que el proceso que permite utilizar la batería para alimentar un dispositivo, los iones se desplazan en sentido opuesto, desde el ánodo hacia el cátodo, igual que los electrones a través del circuito externo, donde se conecta el dispositivo que se quiere hacer funcionar (en la imagen, una bombilla). Fuente: Chaofeng Liu, Zachary G. Neale y GuozhongCao, “Understanding electrochemical potentials of cathode materials in rechargeable batteries” Materials Today, 18, 109 (2016)
28 NOVIEMBRE, 2019
Ignacio Mártil
Catedrático de Electrónica de la Universidad Complutense de Madrid y miembro de la Real Sociedad Española de Física
En el anterior artículo de esta serie, he descrito las principales características y aplicaciones de las baterías recargables con mayor presencia y proyección de futuro del mercado: las baterías de iones de litio (en lo que sigue ion-litio). En este voy a describir cómo tienen lugar los procesos de carga y descarga de las mismas, lo que servirá para entender su enorme utilidad práctica, como por ejemplo las baterías de los teléfonos móviles:PUBLICIDAD
Batería de ion-litio de un teléfono móvil
En las baterías de ion-litio, los iones se mueven en un sentido cuando la batería se carga, es decir, cuando absorbe la energía que le proporciona una fuente externa y se mueven en sentido contrario cuando la batería se descarga, que es el momento en el que la batería está suministrando energía a un determinado dispositivo: un teléfono móvil, un patinete, un vehículo eléctrico, etc. El proceso se muestra en la imagen:
Esquema interno de una batería de ion-litio. Los iones de litio están representados por puntos rojos; en el ánodo, los átomos de carbono están representados por puntos negros, agrupados en capas hexagonales. Durante el proceso e carga de la batería, los iones de litio se desplazan desde el cátodo de LiCoO2 hacia el ánodo de gafito, mientras que los electrones hacen lo mismo, pero a través del circuito externo. En la descarga, que el proceso que permite utilizar la batería para alimentar un dispositivo, los iones se desplazan en sentido opuesto, desde el ánodo hacia el cátodo, igual que los electrones a través del circuito externo, donde se conecta el dispositivo que se quiere hacer funcionar (en la imagen, una bombilla). Fuente: Chaofeng Liu, Zachary G. Neale y GuozhongCao, “Understanding electrochemical potentials of cathode materials in rechargeable batteries” Materials Today, 18, 109 (2016)
1. Proceso de carga
Durante la carga, que se realiza conectando la batería a una fuente de energía externa (la red eléctrica, generalmente), algunos iones de litio abandonan el electrodo positivo de óxido de cobalto y litio (LiCoO2, el cátodo) y fluyen hacia el electrodo negativo de grafito (una variedad del Carbono, el ánodo) a través del electrolito (mostrado en la imagen en color azulado). Los electrones también fluyen desde el electrodo positivo al negativo, pero lo hacen a través del circuito externo. Cuando los iones de litio llegan al grafito, se insertan entre las capas atómicas de ese material, donde se recombinan con los electrones, quedando el litio depositado allí.
Cuando ya no fluyan más iones, la batería está completamente cargada y lista para usar. En este estado de carga, los iones de litio se almacenan entre las diferentes capas de carbono del electrodo de grafito, de manera que en su estado de carga, el ánodo es efectivamente una especie de “bocadillo” integrado por capas de carbono que se alternan con las capas de iones de litio.
En este proceso, la batería almacena energía, dado que el potencial electroquímico del grafito es más elevado que el del óxido de cobalto y litio y por consiguiente, los iones de litio tienen que “subir” desde el potencial al que se encuentran en el cátodo, hasta el del ánodo, para lo que necesitan una fuente externa que les proporcione la energía necesaria para realizar ese camino. Las reacciones químicas que tienen lugar en cada electrodo son las siguientes:
Cátodo: LiCoO2 + Energía externa ⇒ Li1-xCoO2 + xLi+ + xe–
Ánodo: C + xLi+ + xe– ⇒ LixC
2.Proceso de descarga
Durante la descarga, los iones fluyen de regreso desde el ánodo de grafito hacia al cátodo de óxido de cobalto y litio a través del electrolito. Los electrones también fluyen desde el ánodo al cátodo, pero lo hacen a través del circuito exterior, alimentando un ordenador portátil, un teléfono móvil, un vehículo eléctrico, etc. Esto es así dado que los iones de litio en el grafito están a un potencial electroquímico más alto del que tenían en el óxido de cobalto y litio, como ya se ha visto en el párrafo anterior y por lo tanto “bajan” su potencial electroquímico, razón por la que ahora aportan energía al circuito al que se conecten. Ese exceso de energía es el que ceden al circuito exterior, razón por la que cualquier dispositivo que esté conectado a la batería puede realizar su función. A medida que la batería se descarga, los iones se desplazan desde el electrodo de grafito al electrodo de óxido de cobalto. Cuando está completamente descargada, todos los iones de litio se han desplazado de vuelta al electrodo de óxido de cobalto y litio, donde de nuevo se sitúan entre las capas de iones de cobalto y los iones de oxígeno. Las reacciones que tienen lugar ahora en cada electrodo son las inversas a las del proceso de carga, de ahí que las baterías sean reutilizables:
Ánodo: LixC ⇒ C + xLi+ + xe– + Energía
Cátodo: Li1-xCoO2 + xLi+ + xe– ⇒ LiCoO2
La figura muestra el proceso de descarga:
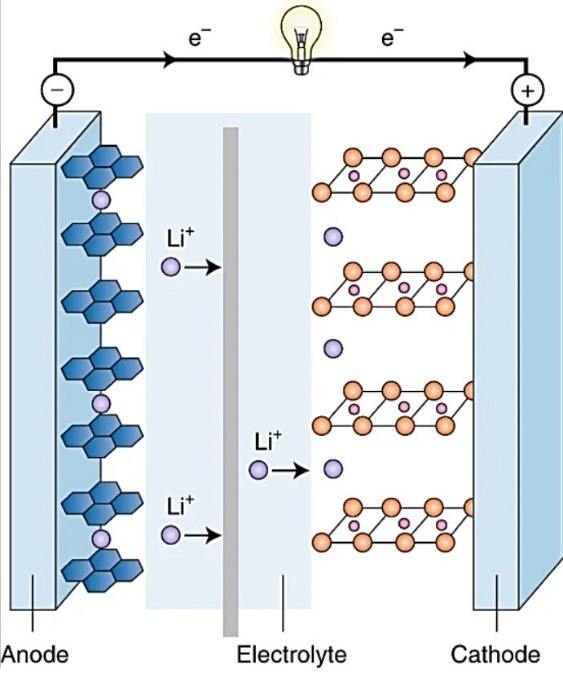
La figura ilustra el proceso de descarga de una batería de ion-litio, durante el cual los iones de litio (Li+) se desplazan desde el cátodo de grafito hacia el ánodo de LiCoO2, mientras que los electrones se mueven a través del circuito exterior, también desde el ánodo hacia el cátodo, alumbrando la bombilla. La fuente de la imagen está tomada de un trabajo de John B. Goodenough, uno de los galardonados este año con el Premio Nobel de Química: “How we made the Li-ion rechargeable battery”, Nature Electronics 1, 204 (2018)
Es decir, en los procesos de carga y descarga de la batería, los iones de litio se desplazan de un electrodo a otro. En ambos casos, los electrones fluyen también desde el mismo electrodo desde el que se mueven los iones de litio, pero lo hacen a través del circuito exterior, ya que los electrones no fluyen a través del electrolito, porque éste es una barrera aislante muy efectiva que impide la circulación de los electrones a través de él.
Durante el proceso de descarga de los iones de litio desde el ánodo al cátodo, se genera una tensión entre los electrodos bastante alta, del orden de 3.5-4 voltios, que es lo que produce cada pila, debida a la diferencia de potenciales electroquímicos existente entre ánodo y cátodo ya indicada. Este valor es mucho más alto que los 1.5 voltios típicos de una celda alcalina AA normal y ayuda a que las baterías de iones de litio sean más compactas, lo que facilita su uso en dispositivos pequeños, como por ejemplo los teléfonos móviles.
El movimiento de los iones (a través del electrolito) y el de los electrones (a través del circuito externo) son procesos interconectados, y si alguno de ellos se detiene, el otro también lo hace. Si los iones dejan de moverse a través del electrolito porque la batería se descarga completamente, los electrones tampoco pueden moverse a través del circuito externo. De manera similar, si se apaga la fuente que esté cargando la batería (por ejemplo, en un corte de la red eléctrica), el flujo de electrones se detiene y también lo hace el flujo de iones. Ambos procesos se muestran en el siguiente vídeo:
Publicado originalmente en: Público